सुगंधित हाइड्रोकार्बन: उनके बारे में सब कुछ। सुगन्धितता: सुगन्धितता के मानदंड, हकेल की सुगन्धितता का नियम, बेंजीनोइड और गैर-बेंजेनॉइड सुगंधित यौगिकों के उदाहरण संरचना और रासायनिक गुण
सुगंधि(ग्रीक सुगंध से, लिंग एरोमाटोस - धूप), एक अवधारणा जो संरचनात्मक, ऊर्जावान के एक सेट की विशेषता है। प्रतिक्रिया के गुण और विशेषताएं। चक्रीय क्षमताएँ संयुग्मित कनेक्शन की एक प्रणाली के साथ संरचनाएं। यह शब्द एफ.ए. केकुले (1865) द्वारा उन यौगिकों के गुणों का वर्णन करने के लिए पेश किया गया था जो संरचनात्मक रूप से वर्ग के पूर्वज के करीब हैं।
सबसे ज्यादा की संख्या में सुगंधितता के महत्वपूर्ण लक्षणों में सुगंधित होने की प्रवृत्ति शामिल है। कॉन. एक ऐसे प्रतिस्थापन के लिए जो चक्र में संयुग्मित बंधों की प्रणाली को संरक्षित करता है, न कि किसी ऐसे अतिरिक्त के लिए जो इस प्रणाली को नष्ट कर देता है। इसके डेरिवेटिव के अलावा, ऐसे समाधान पॉलीसाइक्लिक सुगंधित यौगिकों की विशेषता हैं। (उदाहरण के लिए, और उनके डेरिवेटिव), साथ ही आइसोइलेक्ट्रॉनिक संयुग्मित हेटरोसाइक्लिक्स के लिए। सम्बन्ध। हालाँकि, यह ज्ञात है कि कई कनेक्शन हैं। (, आदि), जो प्रतिस्थापन प्रणालियों में भी आसानी से प्रवेश कर जाते हैं, लेकिन उनमें सुगंध के अन्य सभी लक्षण नहीं होते हैं।
प्रतिक्रिया क्षमता सुगंध की सटीक विशेषता के रूप में भी काम नहीं कर सकती क्योंकि यह न केवल मूल के गुणों को दर्शाती है। इस यौगिक की अवस्था, लेकिन समाधान की संक्रमण अवस्था (सक्रिय परिसर) भी, जिसमें यह संबंध है। प्रवेश करता है. इसलिए, सुगंध के लिए अधिक कड़े मानदंड भौतिक विश्लेषण से जुड़े हैं। मुख्य रूप से सेंट इलेक्ट्रॉनिक अवस्थाएँ चक्रीय हैं। संयुग्मित संरचनाएँ. मुख्य कठिनाई यह है कि सुगन्धितता कोई प्रयोगात्मक रूप से निर्धारित विशेषता नहीं है। इसलिए, सुगंध की डिग्री स्थापित करने के लिए कोई स्पष्ट मानदंड नहीं है, अर्थात। संतों से समानता की डिग्री. नीचे सबसे अधिक माना गया है। सुगंधि के महत्वपूर्ण लक्षण.
सुगंधित प्रणालियों के इलेक्ट्रॉनिक खोल की संरचना।
डीकंप में संयुग्मित रिंग की संरचना को संरक्षित करने के लिए इसके डेरिवेटिव की प्रवृत्ति। परिवर्तन का मतलब उच्चतर है। thermodynamic और गतिज इस संरचनात्मक टुकड़े की स्थिरता. स्थिरीकरण (इलेक्ट्रॉनिक ऊर्जा में कमी) या चक्रीय होना। संरचना, तब प्राप्त होती है जब सभी बाध्यकारी आणविक अणु पूरी तरह से भर जाते हैं और गैर-बाध्यकारी और विरोधी-बाध्यकारी अणुओं की रिक्तियां भर जाती हैं। इन शर्तों की पूर्ति तब होती है जब चक्रीय में कुल संख्या. (4n + 2) के बराबर है, जहाँ n = = 0,1,2... (हुकेल का नियम)।
यह नियम (फॉर्म I) और साइक्लोपेंटैडिएनिल (II; n = 1) की स्थिरता की व्याख्या करता है। इससे साइक्लोप्रोपेनिल (III; n = 0) और साइक्लोहेप्टाट्रिएनिल (IV; n = 1) की स्थिरता का सही अनुमान लगाना संभव हो गया। कॉन के इलेक्ट्रॉनिक कोशों की समानता के कारण। II-IV और वे, उच्च चक्रीय वाले को पसंद करते हैं। - , , (V-VII), को सुगंधित माना जाता है। सिस्टम. 
हुकेल के नियम को संयुग्मित हेटरोसाइक्लिक्स की एक श्रृंखला के लिए विस्तारित किया जा सकता है। कॉन. - डेरिवेटिव (VIII) और पाइरिलियम (IX), आइसोइलेक्ट्रॉनिक, प्रकार X (,) के पांच-सदस्यीय हेटरोसायकल, आइसोइलेक्ट्रॉनिक से साइक्लोपेंटैडिएनिल। इन यौगिकों को भी सुगंधित के रूप में वर्गीकृत किया गया है। सिस्टम. 
I-VII में मेथिन समूहों के आइसोइलेक्ट्रॉनिक प्रतिस्थापन द्वारा प्राप्त यौगिकों II-X और अन्य अधिक जटिल संरचनाओं के व्युत्पन्न भी उच्च थर्मोडायनामिक गुणों की विशेषता रखते हैं। नाभिक में प्रतिस्थापन प्रतिक्रियाओं की स्थिरता और सामान्य प्रवृत्ति।
चक्रीय. संयुग्मित, चक्र में 4n (n=1,2...) वाले, अस्थिर होते हैं और आसानी से अतिरिक्त अवस्था में प्रवेश कर जाते हैं, क्योंकि उनके पास आंशिक रूप से भरे हुए गैर-बंधन वाले खुले इलेक्ट्रॉन शेल होते हैं। ऐसे कनेक्शन, अधिकांश जिसका एक विशिष्ट उदाहरण साइक्लोबुटाडीन (XI) है, जिसमें कैंथियारोमैटिक शामिल है। सिस्टम.
नियम जो एक चक्र में संख्या को ध्यान में रखते हैं, मोनोसाइक्लिक के गुणों को चिह्नित करने के लिए उपयोगी होते हैं। हालाँकि, संरचनाएँ पॉलीसाइकिलों पर लागू नहीं होती हैं। उत्तरार्द्ध की सुगंध का आकलन करते समय, यह ध्यान रखना आवश्यक है कि प्रत्येक व्यक्तिगत चक्र के इलेक्ट्रॉनिक गोले इन नियमों के अनुरूप कैसे हैं। बहु-चार्ज चक्रीय बैटरियों के मामले में इनका उपयोग सावधानी से किया जाना चाहिए। . इस प्रकार, साइक्लोबुटाडाइन के डाइकेशन और डायनियन के इलेक्ट्रॉनिक गोले हकेल के नियम की आवश्यकताओं को पूरा करते हैं। हालाँकि, इन संरचनाओं को सुगंधित के रूप में वर्गीकृत नहीं किया जा सकता है, क्योंकि दिशा (n = 0) समतल रूप में स्थिर नहीं है, जो चक्रीय संरचना प्रदान करती है। संयुग्मन, और तिरछे मुड़े हुए में; डायनियन (n=1) आम तौर पर अस्थिर होता है।
सुगंध के लिए ऊर्जा मानदंड. अनुनाद ऊर्जा.मात्राएँ निर्धारित करने के लिए. सुगन्धितता की विशेषता के माप में वृद्धि हुई thermodynamic स्थिरता सुगंधित कॉन., अनुनाद ऊर्जा (ईआर), या डेलोकलाइज़ेशन ऊर्जा की अवधारणा तैयार की गई थी।
औपचारिक रूप से तीन युक्त ऊष्मा, तीन की ऊष्मा से 151 kJ/ अधिक है। ईआर से जुड़े इस मूल्य को चक्रीय के विनाश पर अतिरिक्त रूप से खर्च की गई ऊर्जा के रूप में माना जा सकता है। एक संयुग्मित बेंजीन रिंग प्रणाली जो इस संरचना को स्थिर करती है। टी. गिरफ्तार, ईआर चक्रीय के योगदान को दर्शाता है। यौगिक के (कुल ऊर्जा, परमाणुकरण की गर्मी) में संयुग्मन।
कई सैद्धांतिक तरीके प्रस्तावित किए गए हैं। ईआर आकलन. वे अलग-अलग हैं। गिरफ्तार. चक्रीय के साथ तुलना संरचना (अर्थात एक संरचना जिसमें चक्रीय संयुग्मन टूट गया है) चुनना। रूप। ईआर की गणना करने का सामान्य तरीका चक्र की इलेक्ट्रॉनिक ऊर्जा की तुलना करना है। संरचना और उसमें निहित सभी पृथक ऊर्जाओं का योग। हालाँकि, गणना की गई गिरफ्तारी। ईआर, इस्तेमाल किए गए क्वांटम रसायन की परवाह किए बिना। विधि, बढ़ते सिस्टम आकार के साथ बढ़ने लगती है। यह अक्सर प्रयोगों का खंडन करता है। संतों के बारे में डेटा सुगंधित. सिस्टम. इस प्रकार, पॉलीएसेन्सेबेंजीन (I), (XII), (XIII), टेट्रासीन (XIV) की श्रृंखला में सुगंध कम हो जाती है (उदाहरण के लिए, जोड़ने की प्रवृत्ति बढ़ जाती है, बंधन लंबाई का विकल्प बढ़ जाता है), और ER (में दिया गया है) इकाई = 75 kJ/) बढ़ जाती है : 
चक्रीय चक्रों की इलेक्ट्रॉनिक ऊर्जाओं की तुलना करके गणना किए गए ईआर मूल्यों में यह खामी नहीं है। संरचना और समान चक्रीय। संयुग्मित पूर्ण (एम. देवर, 1969)। परिकलित टी. मात्राओं को आमतौर पर देवर ईआर (ईडी) कहा जाता है। उदाहरण के लिए, ईडीपी (1.013) की गणना 1,3,5-हेक्साट्रिन के साथ तुलना करके की जाती है, और साइक्लोबुटाडीन की ईडीपी की तुलना = = 1,3-ब्यूटाडीन के साथ की जाती है।
सकारात्मकता से जुड़ाव ईआरडी के मूल्यों को सुगंधित के रूप में वर्गीकृत किया गया है, नकारात्मक मूल्यों को एंटी-एरोमैटिक के रूप में वर्गीकृत किया गया है, और शून्य के करीब ईआरडी मूल्यों को गैर-सुगंधित के रूप में वर्गीकृत किया गया है। यद्यपि ईडीपी मान क्वांटम रासायनिक अनुमान के आधार पर भिन्न-भिन्न होते हैं। गणना विधि, संबंधित. उनका क्रम व्यावहारिक रूप से विधि की पसंद पर निर्भर नहीं करता है। नीचे विद्युत प्रणोदन कारक प्रति एक (विद्युत प्रणोदन बल/ई; इकाइयों में) दिया गया है, जिसकी गणना संशोधनों के अनुसार की गई है। हकेल: 
नायब. ईआरडी/ई, यानी अधिकतम। सुगंध, है. ईआरडी/ई में कमी सुगंधित में कमी को दर्शाती है। अनुसूचित जनजाति। प्रस्तुत आंकड़े सुगंधितता की अभिव्यक्तियों के बारे में स्थापित विचारों के साथ अच्छे समझौते में हैं।
सुगन्धितता के लिए चुंबकीय मानदंड.चक्रीय. संयुग्मन से एक रिंग करंट की उपस्थिति होती है, जो डायमैग्नस के उच्चीकरण का कारण बनती है। ग्रहणशीलता. चूँकि वलय धारा और उच्चाटन के मान चक्रीय की प्रभावशीलता को दर्शाते हैं। जोड़ियां, वे हो सकती हैं। मात्रा के रूप में उपयोग किया जाता है। सुगन्धितता का एक माप.
सुगंधित प्रणालियों में ऐसे यौगिक शामिल होते हैं जिनमें प्रेरित प्रतिचुंबकीय इलेक्ट्रॉनिक रिंग धाराएं समर्थित होती हैं (डायट्रोपिक सिस्टम)। एन्युलेंस (एन = 0,1,2...) के मामले में रिंग करंट की ताकत और विद्युत प्रणोदन के परिमाण के बीच सीधा आनुपातिकता होती है। हालाँकि, गैर-वैकल्पिक (जैसे) और हेट्रोसाइक्लिक के लिए। कॉन. यह निर्भरता और अधिक जटिल हो जाती है। कुछ मामलों में, सिस्टम हो सकता है उदाहरण के लिए, डायट्रोपिक और एंटी-एरोमैटिक दोनों एक साथ। bicyclodecapentaene.
प्रेरकों की उपस्थिति. चक्रीय में वलय धारा संयुग्मित प्रणालियाँ विशिष्ट रूप से प्रोटॉन चुंबकीय स्पेक्ट्रा में प्रकट होती हैं। अनुनाद (पीएमआर), क्योंकि धारा अनिसोट्रोपिक चुंबकीय क्षेत्र बनाती है। वह क्षेत्र जो रसायन को महत्वपूर्ण रूप से प्रभावित करता है रिंग से जुड़े बदलाव। आंतरिक में स्थित सिग्नल भाग सुगंधित रिंगों को एक मजबूत क्षेत्र की ओर स्थानांतरित कर दिया जाता है, और रिंग की परिधि पर स्थित सिग्नल को एक कमजोर क्षेत्र की ओर स्थानांतरित कर दिया जाता है। हाँ, आंतरिक (फॉर्म VI) और (VII) पीएमआर स्पेक्ट्रम में क्रमशः - 60°C पर दिखाई देते हैं। 0.0 और -2.99 मी पर। डी., और बाहरी वाले 7.6 और 9.28 पीपीएम पर।
खुशबूरोधी के लिए इसके विपरीत, एन्युलीन सिस्टम को पैरामैग्नेटिक गुणों की विशेषता होती है। वलय धाराएँ बाहरी में बदलाव की ओर ले जाती हैं एक मजबूत क्षेत्र में (पैराट्रॉपिक सिस्टम)। हाँ, रसायन. एक्सटेंशन शिफ्ट करें केवल 4.8 पीपीएम के बराबर।
सुगंध के लिए संरचनात्मक मानदंड.सबसे महत्वपूर्ण संरचनात्मक विशेषताएँ इसकी समतलता और बंधनों का पूर्ण संरेखण हैं। इसे सुगंधित माना जा सकता है यदि इसमें कार्बन-कार्बन बांड की लंबाई 0.136-0.143 एनएम की सीमा में हो, यानी। (I) के लिए 0.1397 एनएम के करीब। गैर चक्रीय के लिए संयुग्मित पॉलीन संरचनाओं में, सी-सी बांड की लंबाई 0.144-0.148 एनएम है, और सी = सी बांड की लंबाई 0.134-0.135 एनएम है। बांड की लंबाई का और भी अधिक विकल्प एंटीएरोमैटिक्स की विशेषता है। संरचनाएँ। यह कठोर गैर-अनुभवजन्य डेटा द्वारा समर्थित है। ज्यामितीय गणना साइक्लोबुटाडीन और ऍक्स्प के पैरामीटर। इसके डेरिवेटिव के लिए डेटा।
विभिन्न प्रस्तावित मात्राओं के लिए अभिव्यक्तियाँ. उदाहरण के लिए, बांड की लंबाई के प्रत्यावर्तन की डिग्री के आधार पर सुगंध संबंधी विशेषताएं। सुगंध सूचकांक (HOMA d) के लिए:
जहां a = 98.89, X r, r-वें बांड की लंबाई है (A में), n बांड की संख्या है। के लिए
सुगंधित हाइड्रोकार्बन चक्रीय, संयुग्मित यौगिक हैं, जो अपनी संरचना के कारण विशेष भौतिक और रासायनिक गुण प्रदर्शित करते हैं। बाद में, "सुगंधित हाइड्रोकार्बन" की अवधारणा को उनके विशिष्ट भौतिक रासायनिक गुणों के लिए जिम्मेदार ठहराया गया:
- मुख्य रूप से प्रतिस्थापन प्रतिक्रियाओं की प्रवृत्ति;
- ऑक्सीकरण एजेंटों और उच्च तापमान के प्रति प्रतिरोधी।
एरेन्स का सबसे सरल प्रतिनिधि बेंजीन और उसके समरूप, जुड़े हुए बेंजीनॉइड, गैर-बेंजेनॉइड और हेटरोसायक्लिक यौगिक हैं।
एरोमैटिकिटी डेलोकलाइज्ड चक्रीय $\pi$-सिस्टम्स का एक विशेष स्थिरीकरण प्रतीत होता है जिसमें ($4n + 2$) $\pi$-इलेक्ट्रॉन होते हैं। यह "विशेष स्थिरीकरण" ($4n$) $\pi$ चक्रीय प्रणालियों के मामले में नहीं देखा जाता है। छोटे चक्रों के लिए ऐसी प्रणाली अस्थिर हो जाएगी, अर्थात। ऐसी प्रणालियाँ "सुगंधरोधी" होंगी। हालाँकि, विशेष स्थिरीकरण के बारे में बयान के लिए न केवल सैद्धांतिक गणना की आवश्यकता है, बल्कि कुछ प्रयोगात्मक पुष्टि की भी आवश्यकता है। इस संबंध में, सुगंध के लिए विश्वसनीय प्रयोगात्मक मानदंड चुनने का प्रश्न मौलिक महत्व का हो जाता है।
सुगंधि के लक्षण
हाइड्रोकार्बन का सुगंधित चरित्र सुगंधित चक्रों के निर्माण में आसानी और उनके भौतिक और रासायनिक गुणों की ख़ासियत दोनों के कारण होता है।
सुगंधित यौगिकों (एरेन्स) के विशिष्ट गुण उनकी संरचना की विशिष्टता से निर्धारित होते हैं और सुगंधितता के रासायनिक मानदंड निर्धारित करते हैं:
सुगन्धितता के लिए भौतिक-रासायनिक मानदंड
सुगन्धितता का मुख्य मानदंड यह है कि क्या अणु बुनियादी आवश्यकताओं को पूरा करता है:
- अणु चक्रीय और तलीय होना चाहिए;
- अणु में $\pi$-इलेक्ट्रॉनों के संयुग्मन की एक बंद श्रृंखला होनी चाहिए;
- संयुग्मन श्रृंखला में $\pi$-इलेक्ट्रॉनों ($N$) की संख्या हकेल के नियम के अनुरूप होनी चाहिए: $N = 4n + 2$, जहां $n = 0,1,2,3$ ...
इसलिए, संयुग्मन ऊर्जा सुगन्धितता का मुख्य मानदंड है।
यदि कोई यौगिक सुगंधितता के सभी मानदंडों को पूरा करता है, तो अणुओं में संयुग्मन ऊर्जा अपने अधिकतम मूल्य तक पहुंच जाती है, और परिणामस्वरूप यौगिक स्वयं अत्यंत स्थिर हो जाता है। इसलिए, संयुग्मन ऊर्जा सुगन्धितता का मुख्य मानदंड है।
IUPAC परिभाषा के अनुसार, एरोमैटिकिटी को "चक्रीय आणविक प्रणालियों की स्थानिक और इलेक्ट्रॉनिक संरचना की अवधारणा के रूप में वर्णित किया जा सकता है, जो इलेक्ट्रॉनों के चक्रीय डेलोकलाइज़ेशन के प्रभावों को दर्शाती है, जो इन प्रणालियों की बढ़ी हुई थर्मोडायनामिक स्थिरता प्रदान करती है (एसाइक्लिक संरचनात्मक एनालॉग्स की तुलना में) और रासायनिक परिवर्तनों के दौरान संरचनात्मक प्रकार को बनाए रखने की प्रवृत्ति.." "एसाइक्लिक एनालॉग्स" की तुलना में चक्रीय संरचनाओं के स्थिरीकरण के बारे में बोलते हुए, सुगंधितता एक ऊर्जावान टोपोलॉजिकल अवधारणा के रूप में प्रकट होती है जिसका मोटे तौर पर भौतिक-रासायनिक अवलोकनों द्वारा मूल्यांकन किया जा सकता है। "एसाइक्लिक एनालॉग्स" वास्तव में गैर-मौजूद रासायनिक यौगिक भी हो सकते हैं, लेकिन "टोपोलॉजिकल सीमाओं के साथ कल्पना के चित्र।"
सुगंधता का आकलन करने के लिए मानदंड
सुगन्धितता का आकलन करने के मानदंड को अवलोकन के संदर्भ के आधार पर दो श्रेणियों में विभाजित किया जा सकता है - स्थिर (पृथक अणु) और गतिशील (अणु एक बाहरी चुंबकीय क्षेत्र के संपर्क में है)। ऊर्जा मानदंड (प्रतिक्रियाओं की एन्थैल्पी) और संरचनात्मक मानदंड (बंध लंबाई में परिवर्तन) मौलिक रूप से भिन्न चुंबकीय मानदंड (एनएमआर, चुंबकीय संवेदनशीलता में परिवर्तन) निर्धारित करते हैं (तालिका 1)।
चित्र 4. सुगन्धितता मानदंड का वर्गीकरण
संरचनात्मक और ऊर्जावान सुगंध
"संरचनात्मक" सुगंध का आकलन औसत बांड लंबाई और इस औसत से विचलन द्वारा किया जा सकता है।
रिंग-ओपनिंग प्रतिक्रियाओं की एन्थैल्पी के माध्यम से "ऊर्जावान" सुगंध का अनुमान लगाया जा सकता है। अनुनाद ऊर्जा ($RE$), जैसे कि ब्रेस्लो अनुनाद ऊर्जा ($BRE$), की गणना हकेल विधि का उपयोग करके की जाती है, जबकि सुगंधित स्थिरीकरण ऊर्जा ($ASE$) की गणना ab initio विधियों का उपयोग करके की जाती है।
चुंबकीय सुगंधि
"चुंबकीय" सुगंध को आमतौर पर एनएमआर, परमाणु डिकॉउलिंग और एनआईसीएस न्यूक्लियस इंडिपेंडेंट केमिकल शिफ्ट का उपयोग करके निर्धारित किया जाता है, जैसा कि 1996 में श्लेयर द्वारा प्रस्तावित किया गया था।
ऊपर, सुगंधित यौगिकों को ऐसे यौगिकों के रूप में परिभाषित किया गया था जो बेंजीन से मिलते जुलते हैं। लेकिन किसी यौगिक को सुगंधित के रूप में वर्गीकृत करने के लिए बेंजीन के कौन से विशिष्ट गुण होने चाहिए? बेंजीन रिंग वाले यौगिकों के अलावा, कई अन्य पदार्थ भी हैं जिन्हें एरोमैटिक्स कहा जाता है, हालांकि उनमें से कुछ दिखने में बेंजीन से बहुत कम समानता रखते हैं।
सभी सुगंधित यौगिकों के कौन से गुण विशेषता हैं?
अनुभवजन्य दृष्टिकोण से, सुगंधित यौगिक ऐसे यौगिक होते हैं जिनका आणविक सूत्र उच्च स्तर की असंतृप्ति से मेल खाता है और जो, फिर भी, आमतौर पर असंतृप्त यौगिकों की विशेषता वाली अतिरिक्त प्रतिक्रियाओं से नहीं गुजरते हैं। अतिरिक्त प्रतिक्रियाओं के बजाय, ये सुगंधित यौगिक अक्सर बेंजीन की तरह इलेक्ट्रोफिलिक प्रतिस्थापन प्रतिक्रियाओं से गुजरते हैं। अतिरिक्त प्रतिक्रियाओं में जड़ता के साथ-साथ इन यौगिकों की असामान्य स्थिरता भी प्रकट होती है - हाइड्रोजनीकरण और दहन की ऊष्मा का निम्न मान। सुगंधित यौगिकों की एक चक्रीय संरचना होती है - जिसमें आमतौर पर पाँच-, छह- या सात-सदस्यीय वलय होते हैं - और जब भौतिक तरीकों से अध्ययन किया जाता है, तो उनके अणु सपाट (या लगभग सपाट) पाए जाते हैं। इन यौगिकों में प्रोटॉन का एनएमआर स्पेक्ट्रा (धारा 13.18) में लगभग वही रासायनिक बदलाव मान होता है जो बेंजीन और उसके डेरिवेटिव में प्रोटॉन का होता है।
सैद्धांतिक दृष्टिकोण से, किसी यौगिक के सुगंधित होने के लिए, उसके अणु में अणु के तल के ऊपर और नीचे डेलोकलाइज्ड इलेक्ट्रॉनों की एक चक्रीय प्रणाली होनी चाहिए; इसके अलावा, -इलेक्ट्रॉनों के बादल में -इलेक्ट्रॉन अवश्य होने चाहिए। दूसरे शब्दों में, स्थिरता की डिग्री के लिए जो सुगंधित यौगिकों की विशेषता है, अकेले डेलोकलाइज़ेशन पर्याप्त नहीं है। अणु में इलेक्ट्रॉनों की एक कड़ाई से परिभाषित संख्या होनी चाहिए - 2, या 6, या 10, आदि। यह आवश्यकता, जिसे हकल नियम या नियम के रूप में जाना जाता है (एरिच हुकेल, सैद्धांतिक भौतिकी संस्थान, स्टटगार्ट के नाम पर), क्वांटम यांत्रिकी पर आधारित है और -क्लाउड बनाने वाली विभिन्न कक्षाओं को भरने की आवश्यकताओं से जुड़ा है। हुकेल के नियम की वैधता की तथ्यों से अच्छी तरह पुष्टि होती है।
आइए हुकेल के नियम की पुष्टि करने वाले कुछ आंकड़ों पर नजर डालें। बेंजीन में छह-इलेक्ट्रॉन होते हैं, एक सुगंधित सेक्सेट; नंबर छह बेंजीन और इसी तरह के पदार्थों (नेफ़थलीन, एन्थ्रेसीन, फेनेंथ्रीन, अध्याय 35) के अलावा हकेल नंबर है, हम और भी बड़ी संख्या में हेटरोसायक्लिक यौगिकों का सामना करेंगे जिनमें स्पष्ट रूप से परिभाषित सुगंधित गुण हैं; जैसा दिखाया जाएगा, वैसा ही
सुगंधित हेटेरोडिकल्स में वे यौगिक शामिल होते हैं जिनमें सुगंधित सेक्सेट हो सकता है।
अन्य उदाहरणों के रूप में, निम्नलिखित छह यौगिकों पर विचार करें, जिनमें से प्रत्येक में केवल एक अनुनाद संरचना है:

प्रत्येक अणु पाँच या छह समतुल्य संरचनाओं का एक संकर है जिसमें प्रत्येक कार्बन परमाणु पर एक आवेश या अयुग्मित इलेक्ट्रॉन होता है। हालाँकि, इन छह यौगिकों में से, केवल दो असामान्य रूप से स्थिर हैं: साइक्लोपेंटैडिएनिल आयन और साइक्लोहेप्टाट्रिएनिल केशन (ट्रोपिलियम आयन)।
साइक्लोपेंटैडीन हाइड्रोकार्बन के लिए एक असामान्य रूप से मजबूत एसिड है, जो हाइड्रोजन आयन के अमूर्त होने पर बनने वाले आयन की बढ़ी हुई स्थिरता का संकेत देता है। (साइक्लोपेंटैडिएन साइक्लोहेप्टाट्राइन की तुलना में बहुत मजबूत एसिड है, हालांकि बाद के आयन को सात संरचनाओं की अनुनाद द्वारा स्थिर किया जाता है।) डाइसाइक्लोपेंटैडिएनिलिरोन (फेरोसीन) एक सैंडविच संरचना वाला एक स्थिर अणु है जिसमें लौह परमाणु दो पांच-सदस्यीय रिंगों के बीच सैंडविच होता है। सभी कार्बन-कार्बन बांड 1.4 ए लंबे हैं। फेरोसीन वलय विशिष्ट सुगंधित प्रतिस्थापन प्रतिक्रियाओं से गुजरते हैं - सल्फोनेशन और फ्रीडेल-क्राफ्ट्स प्रतिक्रिया।

साइक्लोहेप्टाट्रिएनिल डेरिवेटिव के बीच, यह वह धनायन है जिसमें असामान्य गुण हैं। ट्रॉपिलियम ब्रोमाइड पिघलता है, पानी में अत्यधिक घुलनशील है, लेकिन गैर-ध्रुवीय सॉल्वैंट्स में अघुलनशील है और कार्रवाई पर तुरंत अवक्षेपित हो जाता है। यह व्यवहार कार्बनिक ब्रोमाइड के लिए असामान्य है और सुझाव देता है कि ठोस अवस्था में भी हम एक आयनिक यौगिक से निपट रहे हैं जिसमें धनायन होता है। वास्तव में एक स्थिर कार्बोनियम आयन है।
साइक्लोपेंटैडिएनिल आयन के इलेक्ट्रॉनिक विन्यास पर विचार करें (चित्र 10.5)। प्रत्येक कार्बन परमाणु त्रिकोणीय रूप से संकरणित होता है और दो अन्य कार्बन परमाणुओं और एक हाइड्रोजन परमाणु से बंध जाता है। साइक्लोपेंटैडिएनिल आयन का वलय एक नियमित पंचकोण है, जिसके कोण हैं; अपूर्ण ओवरलैप (कोणीय तनाव) से उत्पन्न होने वाली कुछ अस्थिरता की भरपाई परिणामी डेलोकलाइज़ेशन से होती है। चार कार्बन परमाणुओं के प्रत्येक कक्षक में एक इलेक्ट्रॉन होता है, पांचवें कार्बन परमाणु (वह जिसने एक प्रोटॉन खो दिया है, लेकिन वास्तव में, निश्चित रूप से, दूसरों से अप्रभेद्य है) में इलेक्ट्रॉनों की एक जोड़ी होती है।

चावल। 10.5. साइक्लोपेंटैडिएनिल आयन। ए - कार्बन परमाणुओं में से एक के ए-ऑर्बिटल में दो इलेक्ट्रॉन, अन्य कार्बन परमाणुओं में से प्रत्येक के -ऑर्बिटल में एक इलेक्ट्रॉन; बी - -बॉन्ड के गठन के साथ -ऑर्बिटल्स का ओवरलैप; सी - वलय के तल के ऊपर या नीचे बादल; केवल छह-इलेक्ट्रॉन हैं, यानी, एक सुगंधित सेक्सेट।
-ऑर्बिटल्स के ओवरलैप से -क्लाउड का निर्माण होता है जिसमें कुल छह इलेक्ट्रॉन होते हैं, यानी, एक सुगंधित सेक्सेट।
ट्रोपिलियम आयन के विन्यास को इसी प्रकार दर्शाया गया है। यह एक नियमित सप्तभुज (कोण 128.5° (2.242 रेड) के बराबर) है। छह कार्बन परमाणुओं में से प्रत्येक में एक -इलेक्ट्रॉन होता है, और सातवें में केवल एक खाली -ऑर्बिटल होता है। परिणाम एक सुगंधित सेक्सेट होता है।
विचारित आयनों को सबसे आसानी से निम्नानुसार दर्शाया गया है:

सबसे आम प्रणालियाँ वे हैं जिनकी हुकेल संख्या छह है, जो समझ में आने योग्य है। एक ऐरोमैटिक रिंग के परमाणुओं में -ऑर्बिटल्स होने के लिए, उन्हें -हाइब्रिडाइजेशन में होना चाहिए और इसलिए, आदर्श रूप से -ऑर्बिटल्स के ओवरलैप को संभव बनाने के लिए बॉन्ड कोण बराबर होना चाहिए, जिससे एक का निर्माण हो सके। -बादल, सुगंधित यौगिक समतल या लगभग समतल होना चाहिए। त्रिकोणीय रूप से संकरित परमाणुओं की संख्या जो बहुत अधिक कोणीय तनाव के बिना एक समतल वलय बना सकते हैं, पाँच, छह या सात हैं, और केवल एक समतल वलय एक -बंधन बनाने के लिए पर्याप्त ओवरलैप की अनुमति देता है। छह की हकेल संख्या -इलेक्ट्रॉनों की संख्या से मेल खाती है जिन्हें रिंग परमाणुओं की निर्दिष्ट संख्या द्वारा समग्र प्रणाली में योगदान दिया जा सकता है। (यह कोई संयोग नहीं है कि बेंजीन, एक सुगंधित यौगिक का एक उदाहरण, भी एक आदर्श संरचना है: इसमें छह परमाणु होते हैं जो छह इलेक्ट्रॉन दान करने और एक षट्भुज बनाने में सक्षम होते हैं, जिसके कोण बिल्कुल त्रिकोणीय होते हैं।)
आइए अब विचार करें कि इस बात का क्या प्रमाण है कि अन्य हकेल संख्याएँ भी "जादुई संख्याएँ" हैं? इन मामलों में यह उम्मीद नहीं की जा सकती है कि सुगंधित चरित्र आवश्यक रूप से बेंजीन और संबंधित यौगिकों की तुलना में यौगिकों की अत्यधिक स्थिरता में प्रकट होगा। इस संख्या में कार्बन परमाणुओं वाले छल्ले त्रिकोणीय रूप से संकरित कार्बन परमाणुओं को अच्छी तरह से समायोजित करने के लिए बहुत छोटे या बहुत बड़े होंगे। इसलिए, सुगंध के कारण किसी भी स्थिरीकरण की भरपाई काफी हद तक कोणीय तनाव या से की जा सकती है। -ऑर्बिटल्स या दोनों कारकों के ओवरलैप की निम्न डिग्री।
स्थिरता को केवल तुलनात्मक अर्थ में माना जाना चाहिए, जैसा कि ऊपर साइक्लोपेंटैडिएनिल और साइक्लोहेप्टाट्रिएनिल डेरिवेटिव के लिए किया गया था, और सुगंध का प्रमाण इस तथ्य में देखा जाना चाहिए कि एक या दूसरा अणु संबंधित अणुओं की तुलना में अधिक स्थिर है। प्रयोगात्मक रूप से नियम की पूरी तरह से पुष्टि की गई थी। वर्तमान शोध का उद्देश्य एक अधिक जटिल प्रश्न को स्पष्ट करना है, अर्थात्: एकाधिक आवेशों की उपस्थिति के कारण कोणीय तनाव और इलेक्ट्रोस्टैटिक प्रतिकर्षण के किस अधिकतम प्रतिकूल संयोजन पर अभी भी सुगंध देखी जा सकती है?
(स्कैन देखें)
एरेनेस
सुगंधित हाइड्रोकार्बन (एरेन्स) - चक्रीय हाइड्रोकार्बन, सुगंध की अवधारणा से एकजुट होते हैं, जो संरचना और रासायनिक गुणों में सामान्य विशेषताओं को निर्धारित करते हैं।
वर्गीकरण
अणु में बेंजीन रिंगों की संख्या के आधार पर, एरेन्स को विभाजित किया जाता हैपर:
mononuclear
मल्टी कोर

नामकरण और समावयवता
बेंजीन श्रृंखला हाइड्रोकार्बन का संरचनात्मक पूर्वज है बेंजीन सी 6 एच 6जिनसे समजातों के व्यवस्थित नाम प्राप्त होते हैं।
मोनोसाइक्लिक यौगिकों के लिए, निम्नलिखित गैर-व्यवस्थित (तुच्छ) नाम बरकरार रखे गए हैं:

प्रतिस्थापकों की स्थिति सबसे छोटी संख्याओं में इंगित की जाती है (संख्या की दिशा कोई मायने नहीं रखती),
|
|
|
और द्वि-प्रतिस्थापित यौगिकों के लिए आप संकेतन का उपयोग कर सकते हैं ऑर्थो, मेटा, जोड़ा।
|
|
|
|
यदि रिंग में तीन प्रतिस्थापन हैं, तो उन्हें सबसे कम संख्या प्राप्त होनी चाहिए, अर्थात। पंक्ति "1,2,4" का "1,3,4" पर लाभ है।


1,2-डाइमिथाइल-4-एथिलबेन्जीन (सही नाम) 3,4-डाइमिथाइल-1-एथिलबेन्जीन (गलत नाम)
मोनोप्रतिस्थापित एरेन्स की समावयवता प्रतिस्थापी के कार्बन कंकाल की संरचना के कारण होती है; डी- और पॉलीप्रतिस्थापित बेंजीन होमोलॉग में, अतिरिक्त समावयवता जोड़ी जाती है, जो नाभिक में प्रतिस्थापकों की अलग-अलग व्यवस्था के कारण होती है।
C9H12 संरचना के साथ सुगंधित हाइड्रोकार्बन का समावयवता:
|
|
|
|
|
भौतिक गुण
एरेन्स का क्वथनांक और गलनांक एल्केन्स, एल्केन्स, एल्केनीज़ की तुलना में अधिक होता है, वे थोड़े ध्रुवीय होते हैं, पानी में अघुलनशील होते हैं और गैर-ध्रुवीय कार्बनिक सॉल्वैंट्स में अत्यधिक घुलनशील होते हैं। एरेनास तरल या ठोस होते हैं जिनमें विशिष्ट गंध होती है। बेंजीन और कई संघनित एरेन्स विषैले होते हैं, उनमें से कुछ कार्सिनोजेनिक गुण प्रदर्शित करते हैं। शरीर में संघनित एरेन्स के ऑक्सीकरण के मध्यवर्ती उत्पाद एपॉक्साइड होते हैं, जो या तो सीधे कैंसर का कारण बनते हैं या कार्सिनोजेन के अग्रदूत होते हैं।
अखाड़े प्राप्त करना
कई सुगंधित हाइड्रोकार्बन अत्यधिक व्यावहारिक महत्व के हैं और बड़े औद्योगिक पैमाने पर उत्पादित किए जाते हैं। कई औद्योगिक विधियाँ कोयले और तेल के प्रसंस्करण पर आधारित हैं।
तेल में मुख्य रूप से एलिफैटिक और एलिसाइक्लिक हाइड्रोकार्बन होते हैं; एलिफैटिक या एसाइक्लिक हाइड्रोकार्बन को सुगंधित में बदलने के लिए, तेल को सुगंधित करने की विधियां विकसित की गई हैं, जिसका रासायनिक आधार एन.डी. द्वारा विकसित किया गया था। ज़ेलिंस्की, बी.ए. कज़ानस्की।
1. चक्रीकरण और निर्जलीकरण:
2. हाइड्रोडेस्मेथिलेशन:

3. बेंजीन होमोलॉग कार्बोनिल समूह की कमी के बाद एल्किलेशन या एसाइलेशन द्वारा तैयार किए जाते हैं।
ए) फ्रीडेल-क्राफ्ट्स एल्किलेशन:

बी) फ्रीडेल-क्राफ्ट्स एसाइलेशन:

4. वर्ट्ज़-फिटिंग प्रतिक्रिया द्वारा बाइफिनाइल की तैयारी:
5. फ़्रीडेल-क्राफ्ट्स प्रतिक्रिया द्वारा डिफेनिलमीथेन की तैयारी:
संरचना और रासायनिक गुण.
सुगन्धितता मानदंड:
चक्रीय संयुग्मित प्रणालियों की सैद्धांतिक गणना और प्रायोगिक अध्ययन के आधार पर, यह पाया गया कि एक यौगिक सुगंधित होता है यदि उसमें:
- समतल चक्रीय σ-कंकाल;
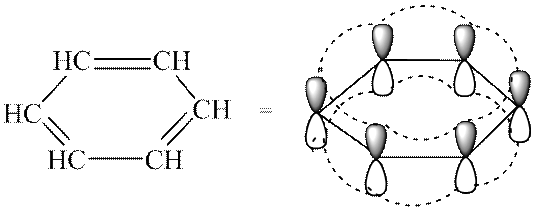
- एक संयुग्मित बंद π-इलेक्ट्रॉन प्रणाली, जो रिंग के सभी परमाणुओं को कवर करती है और इसमें 4n + 2 होता है, जहां n = 0, 1, 2, 3, आदि। इस सूत्रीकरण के रूप में जाना जाता है हुकेल का नियम.सुगन्धितता मानदंड संयुग्मित सुगन्धित प्रणालियों को अन्य सभी से अलग करने की अनुमति देता है। बेंजीन में π इलेक्ट्रॉनों का एक सेक्सेट होता है और n = 1 पर हकेल के नियम का पालन करता है।
सुगंधि क्या देती है:
असंतृप्ति की उच्च डिग्री के बावजूद, सुगंधित यौगिक ऑक्सीकरण एजेंटों और तापमान के प्रति प्रतिरोधी होते हैं, और उनमें अतिरिक्त प्रतिक्रियाओं के बजाय प्रतिस्थापन प्रतिक्रियाओं से गुजरने की अधिक संभावना होती है। इन यौगिकों ने थर्मोडायनामिक स्थिरता में वृद्धि की है, जो सुगंधित रिंग प्रणाली (150 केजे / मोल) की उच्च संयुग्मन ऊर्जा द्वारा सुनिश्चित की जाती है, इसलिए, एरेन्स अधिमानतः प्रतिस्थापन प्रतिक्रियाओं में प्रवेश करते हैं, जिसके परिणामस्वरूप वे सुगंधितता बनाए रखते हैं;
सुगंधित वलय में इलेक्ट्रोफिलिक प्रतिस्थापन प्रतिक्रियाओं का तंत्र:
बेंजीन रिंग की π-संयुग्मित प्रणाली का इलेक्ट्रॉन घनत्व इलेक्ट्रोफिलिक अभिकर्मकों द्वारा हमले के लिए एक सुविधाजनक लक्ष्य है।
आमतौर पर, उत्प्रेरक और उपयुक्त परिस्थितियों का उपयोग करके प्रतिक्रिया के दौरान इलेक्ट्रोफिलिक अभिकर्मक उत्पन्न होते हैं।
ई - वाई → ई δ + - वाई δ - → ई + + वाई -
π-कॉम्प्लेक्स का निर्माण।रिंग के π-इलेक्ट्रॉन बादल के इलेक्ट्रोफाइल द्वारा प्रारंभिक हमले से π-प्रणाली के साथ अभिकर्मक का समन्वय होता है और एक दाता-स्वीकर्ता प्रकार के कॉम्प्लेक्स का निर्माण होता है जिसे कहा जाता है π-कॉम्प्लेक्स.सुगंध प्रणाली बाधित नहीं होती:

σ-कॉम्प्लेक्स का निर्माण।सीमित चरण, जिसमें इलेक्ट्रोफाइल रिंग के π-सिस्टम के दो इलेक्ट्रॉनों के कारण कार्बन परमाणु के साथ एक सहसंयोजक बंधन बनाता है, जो इस कार्बन परमाणु के संक्रमण के साथ होता है एसपी 2 -वी एसपी 3 -संकर अवस्था और सुगंधित विघटन, अणु कार्बोकेशन में बदल जाता है।

-कॉम्प्लेक्स का स्थिरीकरण। यह एक आधार का उपयोग करके σ-कॉम्प्लेक्स से एक प्रोटॉन के अमूर्तन द्वारा किया जाता है। इस मामले में, टूटने वाले सहसंयोजक बंधन सी-एच के दो इलेक्ट्रॉनों के कारण, रिंग की बंद π-प्रणाली बहाल हो जाती है, यानी। अणु सुगंधित अवस्था में लौट आता है:

इलेक्ट्रोफिलिक प्रतिस्थापन की प्रतिक्रियाशीलता और अभिविन्यास पर प्रतिस्थापन का प्रभाव
बेंजीन रिंग पर मौजूद पदार्थ वितरण एकरूपता को बाधित करते हैं π- रिंग का इलेक्ट्रॉन बादल और इस तरह रिंग की प्रतिक्रियाशीलता को प्रभावित करता है।
- इलेक्ट्रॉन-दान करने वाले प्रतिस्थापी (डी) रिंग के इलेक्ट्रॉन घनत्व को बढ़ाते हैं और इलेक्ट्रोफिलिक प्रतिस्थापन की दर को बढ़ाते हैं, ऐसे प्रतिस्थापी कहलाते हैं; सक्रिय करना
- इलेक्ट्रॉन-निकालने वाले पदार्थ (ए) रिंग के इलेक्ट्रॉन घनत्व को कम करते हैं और प्रतिक्रिया दर को कम करते हैं, जिन्हें कहा जाता है कीटाणुरहित करना
एरेनास(एरोमैटिक हाइड्रोकार्बन) - ऐसे यौगिक जिनके अणुओं में एक या अधिक बेंजीन रिंग होते हैं - बांड की एक विशिष्ट प्रकृति के साथ कार्बन परमाणुओं के चक्रीय समूह।
बेंजीन - आणविक सूत्र सी 6 एच 6. यह पहली बार ए. केकुले द्वारा प्रस्तावित किया गया था:
अखाड़ा संरचना.
सभी 6 कार्बन परमाणु अंदर हैं एसपी 2-संकरण. प्रत्येक कार्बन परमाणु 2 बनाता है σ -दो पड़ोसी कार्बन परमाणुओं और एक हाइड्रोजन परमाणु के साथ बंधन, जो एक ही विमान में हैं। कोण 120° हैं। वे। सभी कार्बन परमाणु एक ही तल में स्थित होते हैं और एक षट्भुज बनाते हैं। प्रत्येक परमाणु में एक गैर-संकर होता है आर-वह आवास जिस पर अयुग्मित इलेक्ट्रॉन स्थित है। यह कक्षक तल के लंबवत है, और इसलिए π -इलेक्ट्रॉन बादल सभी कार्बन परमाणुओं पर "फैला हुआ" है:

सभी कनेक्शन समान हैं. संयुग्मन ऊर्जा ऊर्जा की वह मात्रा है जिसे किसी सुगंधित प्रणाली को नष्ट करने के लिए खर्च किया जाना चाहिए।
यह वही है जो बेंजीन के विशिष्ट गुणों को निर्धारित करता है - सुगंध की अभिव्यक्ति। इस घटना की खोज हकेल ने की थी और इसे हुकेल का नियम कहा जाता है।
एरेन आइसोमेरिज्म.
एरेनास 2 समूहों में विभाजित किया जा सकता है:
- बेंजीन डेरिवेटिव:

- सघन क्षेत्र:

एरेन्स का सामान्य सूत्र है साथएनएच 2 एन -6 .
एरेन्स की विशेषता संरचनात्मक समरूपता है, जिसे रिंग में प्रतिस्थापनों की पारस्परिक व्यवस्था द्वारा समझाया गया है। यदि रिंग में 2 प्रतिस्थापन हैं, तो वे 3 अलग-अलग स्थितियों में हो सकते हैं - ऑर्थो (ओ-), मेटा (एम-), पैरा (पी-):

यदि बेंजीन से एक प्रोटॉन "हटा लिया" जाता है, तो एक रेडिकल बनता है - सी 6 एच 5, जिसे एरिल रैडिकल कहा जाता है। प्रोटोजोआ:

एरेन्स को "बेंजीन" शब्द कहा जाता है, जो रिंग में प्रतिस्थापन और उनकी स्थिति को दर्शाता है:

अखाड़ों के भौतिक गुण.
श्रृंखला के पहले सदस्य एक विशिष्ट गंध वाले रंगहीन तरल पदार्थ हैं। वे कार्बनिक विलायकों में अत्यधिक घुलनशील होते हैं, लेकिन पानी में अघुलनशील होते हैं। बेंजीन विषैला होता है, लेकिन इसकी गंध सुखद होती है। सिरदर्द और चक्कर का कारण बनता है; बड़ी मात्रा में वाष्प के साँस लेने से चेतना की हानि हो सकती है। श्लेष्मा झिल्लियों और आँखों में जलन पैदा करना।
अखाड़े प्राप्त करना।
1. तेल बनाने वाले संतृप्त हाइड्रोकार्बन के "सुगंधीकरण" का उपयोग करके स्निग्ध हाइड्रोकार्बन से। जब प्लैटिनम या क्रोमियम ऑक्साइड के ऊपर से गुजारा जाता है, तो डाइहाइड्रोसायक्लाइजेशन होता है:

2. साइक्लोअल्केन्स का डिहाइड्रोजनीकरण:

3. एसिटिलीन (ट्रिमराइजेशन) से जब 600°C पर गर्म कोयले के ऊपर से गुजारा जाता है:

4. फ्रीडेल-शिल्प प्रतिक्रियाएल्यूमीनियम क्लोराइड की उपस्थिति में:

5. सुगंधित अम्लों के लवणों का क्षार के साथ संलयन:
एरेन्स के रासायनिक गुण।
एरीन प्रतिस्थापन प्रतिक्रियाएँ।
एरेन कोर में एक मोबाइल है π - एक प्रणाली जो इलेक्ट्रोफिलिक अभिकर्मकों से प्रभावित होती है। एरेन्स को इलेक्ट्रोफिलिक प्रतिस्थापन की विशेषता है, जिसे निम्नानुसार दर्शाया जा सकता है:

एक इलेक्ट्रोफिलिक कण आकर्षित होता है π -रिंग प्रणाली, फिर अभिकर्मक के बीच एक मजबूत बंधन बनता है एक्सऔर कार्बन परमाणुओं में से एक, ऐसी स्थिति में वलय की एकता भंग हो जाती है। सुगन्धितता को बहाल करने के लिए, एक प्रोटॉन और 2 इलेक्ट्रॉन उत्सर्जित होते हैं एस-एनरिंग के π-सिस्टम में गुजरें।
1. हैलोजनीकरण उत्प्रेरक की उपस्थिति में होता है - एल्यूमीनियम और लोहे के निर्जल क्लोराइड और ब्रोमाइड:

2. एरेन्स का नाइट्रेशन। गर्म करने पर बेंजीन सांद्र नाइट्रिक एसिड के साथ बहुत धीमी गति से प्रतिक्रिया करता है। लेकिन यदि आप सल्फ्यूरिक एसिड मिलाते हैं, तो प्रतिक्रिया बहुत आसानी से आगे बढ़ती है:
3. सल्फोनेशन 100% सल्फ्यूरिक एसिड - ओलियम के प्रभाव में होता है:
4. ऐल्कीनों के साथ ऐल्किलीकरण। परिणामस्वरूप, श्रृंखला बढ़ाव होता है, प्रतिक्रिया एक उत्प्रेरक - एल्यूमीनियम क्लोराइड की उपस्थिति में आगे बढ़ती है:
एरेने योगात्मक अभिक्रियाएँ।
1. एरेन्स का हाइड्रोजनीकरण (उत्प्रेरक के साथ):

2. बेंजीन वाष्प और मजबूत यूवी विकिरण की परस्पर क्रिया के कारण रेडिकल हैलोजनेशन। परिणामस्वरूप, एक ठोस उत्पाद बनता है - सी 6H6Cl6:

3. वायु ऑक्सीजन द्वारा ऑक्सीकरण। प्रतिक्रिया वैनेडियम (V) ऑक्साइड और 400°C पर होती है:

बेंजीन होमोलॉग्स में कई अंतर हैं - उनके उत्पादों के लिए मैं रिंग में मूल प्रतिस्थापन हूं:
रिंग में प्रतिस्थापन केवल उत्प्रेरक (लौह और एल्यूमीनियम क्लोराइड) की उपस्थिति में संभव है; प्रतिस्थापन एल्काइल रेडिकल के सापेक्ष ऑर्थो- और पैरा-स्थिति में होता है:

यदि मजबूत ऑक्सीकरण एजेंट (पोटेशियम परमैंगनेट) कार्य करते हैं, तो एल्काइल श्रृंखला नष्ट हो जाती है और बेंजोइक एसिड बनता है:


विषय पर अतिरिक्त सामग्री: एरेनास। अखाड़ों के गुण.
रसायन विज्ञान ग्रेड 7,8,9,10,11, एकीकृत राज्य परीक्षा, राज्य परीक्षा |
|
| अध्ययन और परीक्षा की तैयारी के लिए रसायन विज्ञान पाठ्यक्रम पर बुनियादी जानकारी, जीवीई, एकीकृत राज्य परीक्षा, ओजीई, जीआईए | |













